国产首个:君实启动PD-1皮下注射剂一线治疗非鳞NSCLC III期临床
近日,药物临床试验登记与信息公示平台显示,君实生物的特瑞普利单抗(JS001)皮下注射剂JS001sc启动了一项多中心、开放、随机对照的III期研究,旨在评估JS001sc联合标准化疗 vs. JS001联合标准化疗一线治疗复发或转移性非鳞非小细胞肺癌(NSCLC)的药代动力学特征、疗效、安全性。这也是国产首款进入III期临床阶段的PD-1抗体皮下制剂。
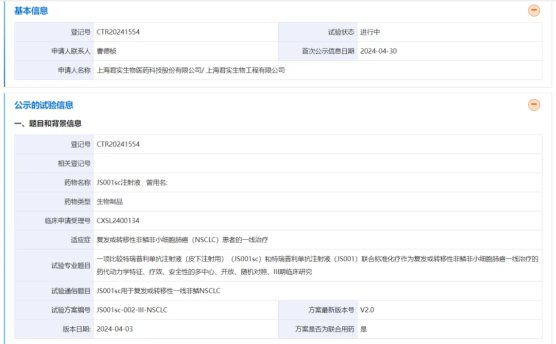
该研究拟纳入356例患者,主要终点指标包括第1周期结束时的实测谷浓度(Ctrough)以及0-21天的药时曲线下面积(AUC0-21day);次要终点指标包括客观缓解率(ORR)、无疾病进展期(PFS)、6个月PFS率、疾病控制率(DCR)、持续缓解时间(DoR)、安全性、PK参数等。
今年4月,君实生物JS001sc用于晚期鼻咽癌的I期研究亮相AACR年会,有38例复发或转移性鼻咽癌患者入组临床研究。第一周期PK分析结果显示,360mg JS001sc(Q3W)的暴露量(AUC0-21天和Ctrough)与240 mg JS001(Q3W)相当。
此外,240mg、360mg和480mg JS001sc组的ORR分别为100%、92.3%和92.3%。截至2023年11月20日,71.1%(27/38)患者肿瘤仍持续缓解。该研究未发现新的安全信号,≥3级不良事件(AE)发生率为76.3%。
目前已经有多家企业正在开发PD-(L)1皮下注射疗法,罗氏阿替利珠单抗皮下注射剂Tecentriq SC已率先在英国获批上市,与耗时30-60分钟的静脉输注相比,Tecentriq SC大约仅需7分钟;BMS纳武利尤单抗皮下注射剂已完成III期临床研究;默沙东K药皮下注射剂已于2023年2月开展了关键III期临床研究,预计将于2024年第3季度完成;此外,百济神州也在开发替雷利珠单抗皮下注射剂,目前处于I期研究阶段。
总的来说,皮下注射剂型的推出不仅能够帮助企业延长品牌药专利期,还能显著减少患者接受治疗时间,节省时间成本。相信未来随着癌症治疗向慢病化发展,皮下注射剂型凭借更优的依从性将会拥有广阔的市场空间
文章来源:医药魔方(声明:发表/转载本文仅仅是出于传播信息的需要,并不意味着代表公司观点或证实其内容的真实性。据此内容作出的任何判断,后果自负。若有侵权,告知必删。)



